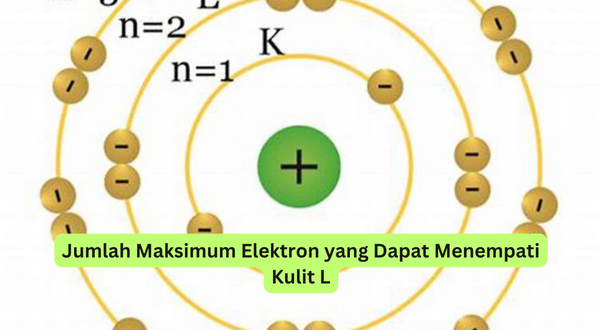
Apa itu Kulit L pada Atom?
Sebelum membahas berapa jumlah maksimum elektron yang dapat menempati kulit L pada atom, kita perlu mengetahui terlebih dahulu apa itu kulit L. Kulit L merupakan salah satu dari empat kulit (K, L, M, dan N) yang dimiliki oleh atom. Kulit L terletak setelah kulit K dan dapat menampung maksimal 8 elektron.
Bagaimana Konfigurasi Elektron di Kulit L?
Konfigurasi elektron di kulit L dapat dituliskan menggunakan notasi elektron. Misalnya, konfigurasi elektron atom klorin (Cl) adalah 1s2 2s2 2p6 3s2 3p5. Dalam notasi tersebut, 3s2 3p5 menunjukkan konfigurasi elektron di kulit L.
Jumlah Maksimum Elektron di Kulit L
Setiap kulit memiliki jumlah maksimum elektron yang dapat menampungnya. Kulit K dapat menampung maksimal 2 elektron, kulit L dapat menampung maksimal 8 elektron, kulit M dapat menampung maksimal 18 elektron, dan kulit N dapat menampung maksimal 32 elektron. Oleh karena itu, jumlah maksimum elektron yang dapat menempati kulit L pada atom adalah 8.
Mengapa Jumlah Maksimum Elektron di Kulit L Adalah 8?
Jumlah maksimum elektron ini adalah 8 karena kulit L memiliki 4 subkulit, yaitu s, p, d, dan f. Setiap subkulit dapat menampung maksimal 2 elektron kecuali subkulit p yang dapat menampung maksimal 6 elektron. Oleh karena itu, jumlah maksimum elektron di kulit L adalah 2 + 6 = 8.
Contoh Konfigurasi Elektron di Kulit L
Selain atom klorin yang telah disebutkan sebelumnya, ada beberapa atom lain yang memiliki konfigurasi elektron di kulit L. Berikut adalah contoh-contoh konfigurasi elektron di kulit L:
– Fluor (F): 1s2 2s2 2p5
– Neon (Ne): 1s2 2s2 2p6– Sodium (Na): 1s2 2s2 2p6 3s1
– Magnesium (Mg): 1s2 2s2 2p6 3s2
– Aluminium (Al): 1s2 2s2 2p6 3s2 3p1
Apa Fungsi Kulit L pada Atom?
Kulit L pada atom memiliki beberapa fungsi, antara lain:
– Untuk menentukan sifat kimia atom, karena elektron di kulit L adalah elektron valensi yang paling luar
– Menentukan reaktivitas atom, karena elektron di kulit L mudah berinteraksi dengan elektron dari atom lain untuk membentuk ikatan kimia
– Menentukan spektrum atom, karena perpindahan elektron dari kulit K ke kulit L dapat menghasilkan pancaran sinar pada spektrum atom
Bagaimana Memperkirakan Konfigurasi Elektron pada Atom?
Untuk memperkirakan konfigurasi elektron pada atom (klik disini), kita dapat menggunakan aturan Aufbau. Aturan Aufbau menyatakan bahwa elektron akan terisi pada subkulit terendah yang tersedia terlebih dahulu. Misalnya, elektron akan terisi pada subkulit 1s sebelum terisi pada subkulit 2s. Selain itu, aturan Hund juga dapat digunakan untuk memperkirakan konfigurasi elektron. Aturan Hund menyatakan bahwa elektron akan terisi pada orbit dengan jumlah spin yang sama terlebih dahulu sebelum terisi pada orbit dengan jumlah spin yang berbeda.
Kesimpulan
Jumlah maksimum elektron yang dapat menempati kulit L pada atom adalah 8. Ini disebabkan karena kulit L memiliki 4 subkulit dan dapat menampung maksimal 2 elektron untuk subkulit s dan maksimal 6 elektron untuk subkulit p. Kulit L memiliki beberapa fungsi penting dalam sifat kimia atom, reaktivitas atom, dan spektrum atom. Untuk memperkirakan konfigurasi elektron pada atom, dapat digunakan aturan Aufbau dan aturan Hund.
Semoga bermanfaat.
 Blog News Portal Berita Teknologi Populer
Blog News Portal Berita Teknologi Populer